12.sınıf fizik atom fiziğine giriş ünitesi, Bohr atom modeli konu anlatımı. Hidrojen atomu enerji seviyeleri ve ışımalar ders notları.
Bohr tarafından 1913 yılında Rutherford atom modeli temel alınarak bu modelin eksiklerini gidermeye çalışan yeni bir atom modeli ortaya konmuştur. Bohr çalışmalarından Max Planck kuantum teorisini kullanmıştır ve ısınan cisimlerden yayılan ışınlar incelemiştir.
Bohr’un yeni atom modelinde iki önemli varsayım vardır.
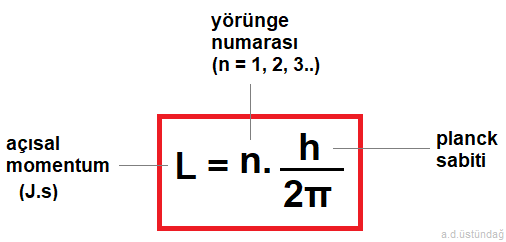
1- Elektron çekirdek çevresinde açısal momentumun h/2π ‘nin tam katları olan kararlı yörüngelerde, ışıma yapmadan dolanır.
2- Elektron yüksek enerjili bir yörüngeden düşük enerjili kararlı bir yörüngeye kendiliğinden geçebilir. Bu geçiş sırasında yörüngelerin enerji farkı kadar enerjiye sahip foton yayınlar.
1- Elektronun açısal momentumu
Elektron çekirdek etrafında çembersel bir yörünge çizerek hareket ediyorsa açısal momentuma sahip olacaktır.
L = elektronun açısal momentumu (j.s),
n = yörünge numarası ( n =1,2,3.. olmak üzere),
H = planck sabiti (6,62.10-34 j.s)
açısal momentum formülü;
Özellikleri:
1- Açısal momentum her değeri alamaz, kesikli değerler alabilir.
2- Değeri sıfır olamaz.
3- Atoma bağlı değildir, büyüklüğü yörüngeye göre değişir.
4- Yörünge numarası ile doğru orantılıdır.
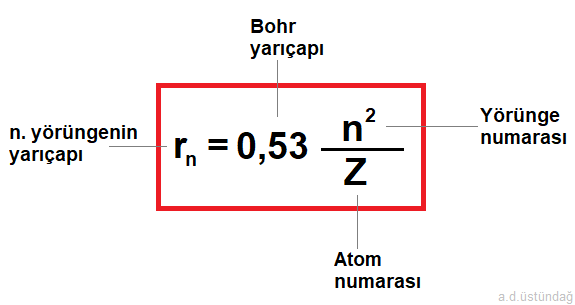
2- Elektronun yörünge yarıçapı
Merkezcil kuvvet ile elektriksel kuvvetin etkisinde elektronlar yörüngede tutulur. Bu iki kuvvetin eşitliğinden aşağıda yarıçap denklemi ortaya çıkar.
Bohr yarıçapı : Hidrojen atomunda 1. yörüngenin yarıçapına Bohr yarıçapı denir. Değeri sabittir ve 0,53 Ao dur.
rn = elektronun bulunduğu n. yörüngenin yarıçapı.
n = yörünge numarası ( n =1,2,3.. olmak üzere),
Z = Atom numarası olmak üzere
elektronun yörünge yarıçap formülü;
Özellikleri:
1- Yarıçap her değeri alamaz, kesikli değerler alabilir.
2- Yarıçap ile atom numarası ters orantılıdır.
3- Yörünge numarası ile doğru orantılıdır.
3- Elektronun toplam enerjisi
Toplam enerji elektronun bulunduğu yörüngedeki potansiyel ve kinetik enerjilerinin toplamıdır.
En = elektronun n. yörüngede toplam enerjisi
n = yörünge numarası ( n =1,2,3.. olmak üzere),
Z = Atom numarası olmak üzere
elektronun toplam enerji formülü;
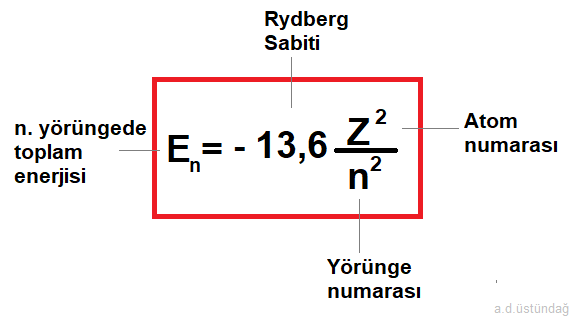
Denklemde (-) ifadesi, elektronun enerjisinin çekirdekten uzaklaştıkça azaldığını gösterir. Toplam enerji sıfır olduğunda, elektron atomdan uzaklaşmış olur.
Özellikleri:
1- Toplam enerji her değeri alamaz, kesikli değerler alabilir.
2- Yörünge numarası büyüdükçe, toplam enerji sıfıra yaklaşır.
3- Çekirdeğe en yakın iken (n =1) en büyük değeri alır.
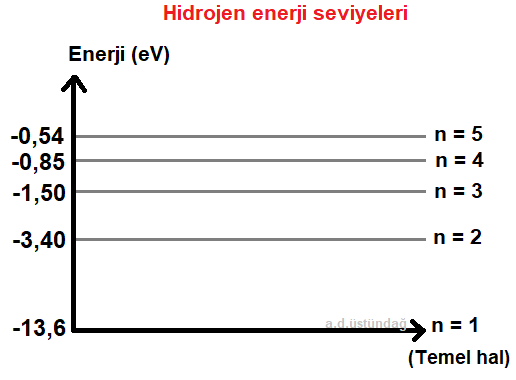
Hidrojen atomunun enerji seviyeleri
Temel hal : Hidrojen atomunda elektronun n=1 yörüngesinde bulunma durumuna temel hal denir. Atom bu durumda kararlıdır ve ışıma yapmaz.
Enerji seviyeleri : Elektronların yörüngede iken alabileceği enerji değerleridir.
Elektronun bir yörüngede bulunabilmesi için bu enerji değerlerinden birini alması gerekir.
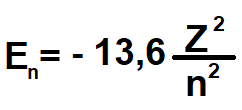
Enerji denkleminde Z yerine Hidrojen atom numarası (Z = 1) ve n yerine yörünge numarası (n =1,2,3… gibi) yazılarsa,
Elektronların her bir yörüngede sahip olması gereken enerji değeri bulunur.
n = 1 iken elektron temel haldedir, temel durumda sahip olması gereken enerji;
n = 1 iken E1 = -13,6 eV
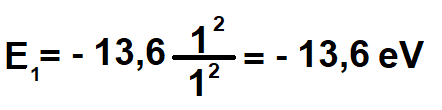
n = 2 iken E2 = -3.4 eV
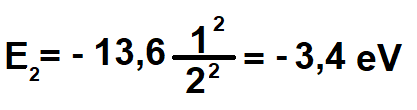
n = 3 iken E3 = -1,51 eV
n = 4 iken E4 = -0,85 eV
n = 5 iken E5 = -0,54 eV bulunur
Enerji değerleri kesiklidir, elektron her enerji değerini alamaz, sadece yukarıdaki verilen değerleri alabilir ve böylece bir yörüngede bulunur.
Uyarılma
Atoma enerji verilerek elektronların temel halden uzaklaşmasına uyarılma denir.
Uyarılma için gerekli enerjiye uyarılma enerjisi denir.
Işıma (Emisyon)
Uyarılan elektron kısa bir süre (10-8 saniye) sonra tekrar temel hale döner ve fazla enerjisini foton olarak yayınlar bu olaya ışıma denir.
İyonlaşma
Uyarılma sonucunda elektron atomdan koparak uzaklaşıyorsa bu olaya iyonlaşma denir.
Elektronu atomdan koparmak için gerekli enerjiye iyonlaşma enerjisi denir.
Aşağıda hidrojen atomunun uyarılma enerjileri verilmiştir.
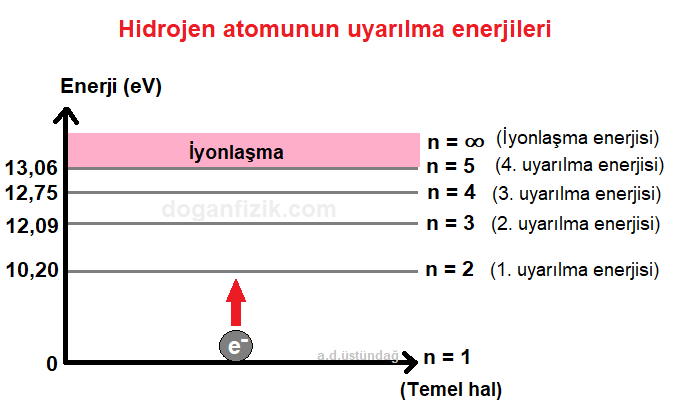
Bir elektronu bir üst yörüngeye çıkarmak için iki yörüngenin enerjilerinin farkı kadar enerji verilmelidir.
Birinci uyarıma seviyesi
n = 1 yörüngesinde (temel halde) bulunan elektronu n = 2 yörüngesine çıkarmak için;
E = E2 – E1
= -3,40 – (-13,6)
= 10,20 eV enerji verilmelidir.
İkinci uyarılma seviyesi
n = 1 yörüngesinde bulunan elektronu n = 3 yörüngesine çıkarmak için;
E = E3 – E1
= -1,51 – (-13,6)
= 12,09 eV enerji verilmelidir.
Atomun uyarılma türleri
1- Atomu ısıtarak uyarılma
Isıtılan atomda enerji kazanan elektronlar temel halden üst yörüngelere çıkarlar ve kısa bir süre sonra kazandıkları enerjiyi foton olarak yayınlar ve tekrar temel hale dönerler.
2- Atomların çarpışmasıyla uyarılma
Yüksek sıcaklıklarda daha hızlı hareket eden atomlar birbiriyle daha sık çarpışırlar. Çarpışma sonucunda birbirlerine enerji aktarırlar. Bu enerji ile elektronlar üst yörüngelere çıkar ve kısa bir süre sonra temel hale geri döner ve foton yayınlar.
3- Atomun elektronlarla uyarılması
Temel halde bulunan bir elektrona dışarıdan bir elektron gönderilir. Elektronlar esnek çarpışma yaptıktan sonra gönderilen elektronun enerjisi yeterli ise uyarılma gerçekleşir, yeterli değilse elektron uyarılamaz.
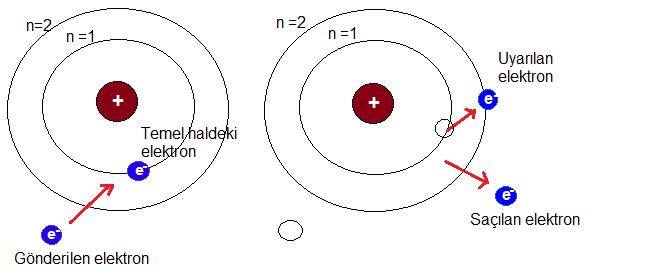
Gönderilen elektron çarpışma sonucunda kalan enerjisi ile yoluna devam eder.
Gönderilen elektronun enerjisi çok büyükse birden fazla elektronu uyarabilir. Ancak aynı elektronu tekrar uyaramaz.
Uyarılan elektron bir süre sonra, kazandığı enerjiyi ışıma yaparak temel hale geri döner.
4- Atomun fotonlarla uyarılması
Temel haldeki elektrona foton gönderilir ve foton elektrona çarptıktan sonra enerjisini aktarır ve yok olur.
Elektronun uyarılabilmesi için fotonun enerjisi mutlaka uyarılma enerjilerinden birine eşit olmalıdır.
Uyarılan elektron temel hale dönerken foton yayınlar, bu foton elektrona gönderilen foton değildir. Ancak elektrona gönderilen foton ile elektronun yayınladığı foton eşit frekanslıdır.
Uyarılma sonucu elektron iyonlaşıyorsa, yan atomdan kopuyorsa tekrar temel hale dönemezler ve ışıma yapmazlar.
Kendiliğinden Emisyon
Yukarıda bahsettiğimiz yollardan biriyle uyarılan elektronun kendiliğinden temel hale gelmesine kendiliğinden emisyon denir.
Elektronlar temel hale geçerken, bulunduğu yörünge ile temel hal arasındaki enerji farkı kadar foton yayınlar.
Yine temel hale geçerken bazen doğrudan temel hale geçebilir bazen ise farklı yörüngelere uğrar ve sonra temel hale geçer böylece birden fazla farklı frekanslı ışımalar yapabilir.
n. yörüngede bulunan elektronun yapabileceği ışıma sayısı aşağıdaki eşitlikle bulunur.

Aşağıda elektronun temel hale geçerken yapabileceği ışıma serileri verilmiştir.
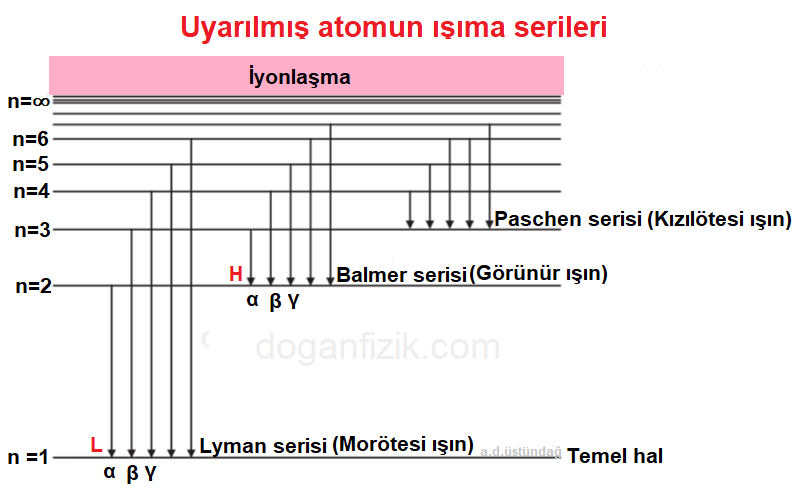
Elektron daha üst yörüngelerde buluyorken;
n = 1 yörüngesine (temel hale) iniyorsa yaptığı ışıma türü Lyman ışımasıdır, mor ötesi ışıma yapar.
n = 2 yörüngesine iniyorsa Balmer serisi ışıması yapar yani görünür ışın yayınlar.
n = 3 yörüngesine iniyorsa Paschen serisi ışıma yapar, kızılötesi ışın yayınlar.
Birden fazla ışıma serisi de yayınlayabilir.
Örneğin 5. yörünge iken önce 2. yörüngeye uğrar ve daha sonra temel hale düşebilir. Bu durumda önce Balmer gama, sonra Lyman alfa serisi ışıma yapmış olur.
Bohr atom modeli;
Yörünge sayısı artarsa;
Çizgisel hız, açısal hız, çizgisel momentum, kinetik enerji azalır.
Yörünge yarıçapı, açısal momentum, periyot ve potansiyel enerji art






